
近日,深圳技术大学健康与环境工程学院科研团队创新地开发了一种联合策略,通过利用双金属Cu@Ru核壳纳米粒子联合内-外源刺激来增强动力学肿瘤治疗。该成果以“Bimetallic Cu@Ru Core-Shell Structures with Ligand Effects for Endo-Exogenous Stimulation-Mediated Dynamic Onco-therapy”为题,在国际纳米科技领域著名期刊Nano Letters在线发表论文,深圳技术大学/深圳大学联培博士生郑喃喃为论文第一作者,深圳技术大学健康与环境工程学院胡俊青教授与胡鑫副教授为共同通讯作者,深圳技术大学为第一作者单位、第一完成单位和第一通讯单位。
目前,癌症仍然是威胁人类健康的最重要疾病。传统的癌症治疗方法有化疗、放射治疗和手术治疗。然而,这些传统疗法存在一定的局限性,如化疗和放疗在治疗癌症的同时也会损害正常组织,对机体产生毒副作用;手术治疗容易出现肿瘤切除不彻底的情况,导致癌症复发。因此,对有效的癌症治疗新方法的研究尤为重要。
活性氧(reactive oxygen species,ROS)在正常细胞内,氧化与抗氧化系统维持在相对平衡的状态,促氧化水平的升高或抗氧化能力的减弱都会导致体内ROS含量的升高,从而引起一系列变化。肿瘤细胞内ROS水平高于正常细胞,所以肿瘤细胞处于氧化应激状态,对ROS的敏感度较高,可以通过提高肿瘤细胞内ROS的水平来达到治疗的目的。目前,以增加肿瘤细胞内ROS水平为目的的药物渐渐应用于临床。
动力学疗法诱导纳米材料产生ROS来诱导肿瘤细胞死亡,目前被认为是很有前途的抗癌策略。ROS产生来自两种不同的刺激来源:外源性能量激活刺激(如光、超声、电等)和对肿瘤微环境特性(如弱酸、过表达谷胱甘肽、过氧化氢和酶等)响应的内源性反应。其中,外源性光和超声触发的光动力疗法和声动力疗法通过激活纳米材料产生高毒性的ROS而受到广泛关注;而内源性刺激触发的化学动力疗法能够巧妙地利用TME中弱酸和过氧化氢,在肿瘤内原位产生ROS。值得注意的是,由于肿瘤的复杂性和异质性,无论是内源性刺激还是外源性刺激,单一刺激下的动力学治疗的疗效都是有限的。因此,需要设计和开发内源性和外源性刺激相结合的治疗方法,以进一步提高动力学治疗的抗癌效果。
基于这一概念,深技大科研团队创新地开发了一种联合策略,通过利用双金属Cu@Ru核壳纳米粒子联合内-外源刺激来增强动力学肿瘤治疗。Cu@Ru NPs可以在外源激光和超声的双重刺激下,将水和氧分子通过氧化还原反应产生外源性的ROS。同时,利用肿瘤微环境中过表达的过氧化氢原位产生内源性ROS,并且消耗谷胱甘肽(与氧化物质ROS发生反应),解除了ROS一边产生一边被消耗的窘境,从而促进肿瘤细胞内部ROS的大量积累。这种合理设计实现了内-外源的联合刺激,触发ROS的大爆发,从而高效诱导肿瘤细胞发生凋亡和铁死亡。通过密度泛函理论计算验证了Cu@Ru核壳结构中Ru壳吸附水和氧分子的能力;Cu@Ru核壳结构中的配体效应促进了Ru壳层电子结构的调制,导致d带中心向费米能级移动,这种调整增强了对水和氧分子的吸附,确保了光/声动力治疗的可靠ROS来源。同时,Cu@Ru核壳结构之间的异质界面可以快速分离电子和空穴对,与吸附的水和氧分子引发氧化还原反应产生大量的ROS。
这是首次通过DFT计算合理设计的核-壳模型揭示了双金属核壳材料的电子结构与产生ROS之间的关系。Cu@Ru NPs在外源激发的光/声动力治疗和内源刺激激发的化学动力学治疗联合作用下,在体外细胞和小鼠肿瘤模型中均能有效地诱导肿瘤细胞死亡和抑制肿瘤生长。这是在单一纳米平台上进行的内-外源联合刺激介导的动力学肿瘤治疗的新策略,为肿瘤协同治疗和相关临床转化提供了新视角。
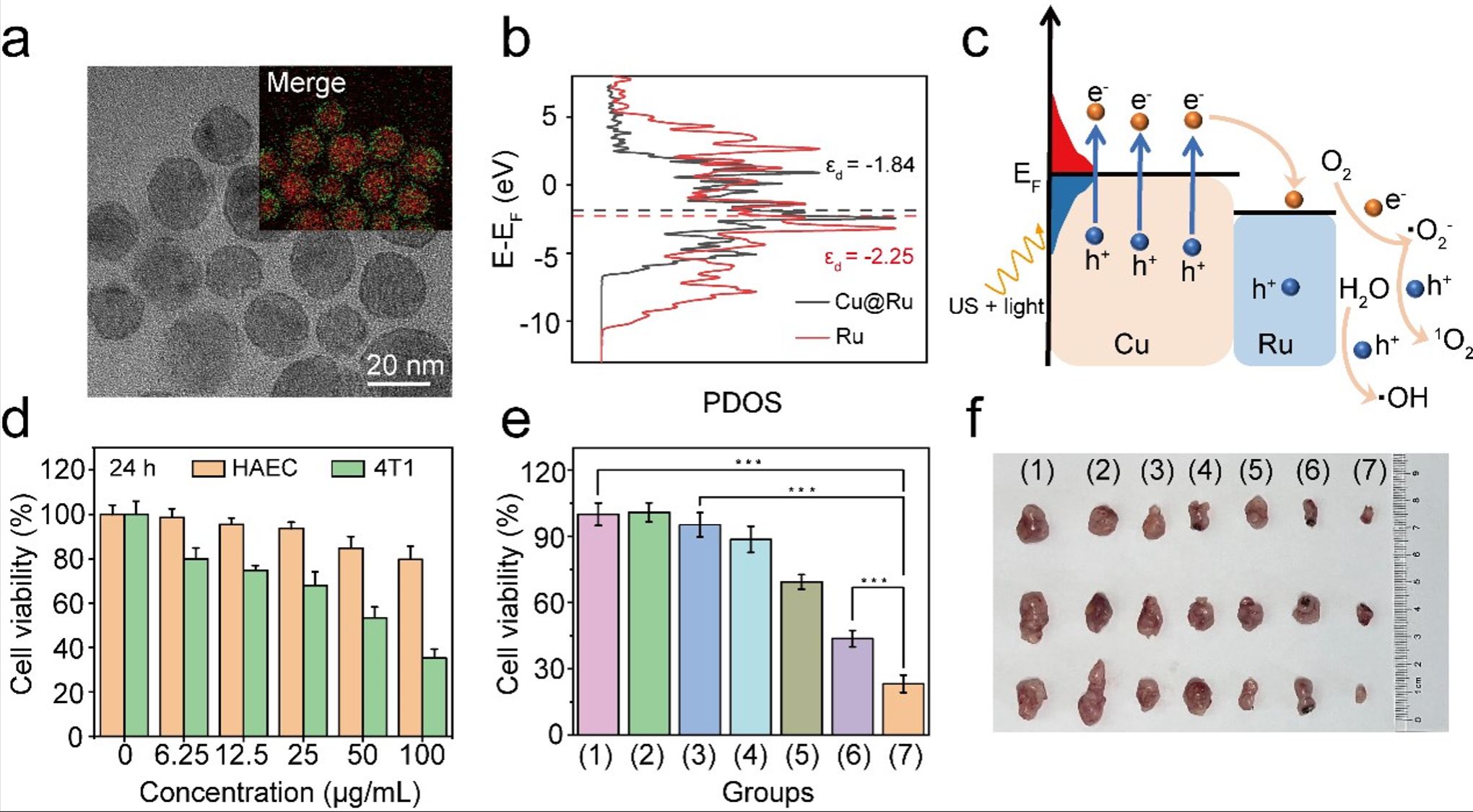
图1. (a)Cu@Ru核壳材料的TEM图像。(b)Cu@Ru NP和Ru NP中Ru的d带中心。(c)Cu@Ru核壳结构生成ROS的机理示意图。(d)与不同浓度Cu@Ru-PEG NPs孵育24h后HAEC(正常细胞)和4T1(肿瘤细胞)的活力。(e)经过不同处理后4T1细胞的活力。(f)治疗后剥离的小鼠肿瘤数码照片。
本研究得到了国家自然科学基金项目、广东省高校共同创新团队项目、深圳湾实验室开放基金项目、深圳技术大学高层次人才科研启动项目等的资助与支持。
稿件来源:健康与环境工程学院